看似简单的疏水效应与去溶剂化,我们到底懂了多少?
大家应该都知道疏水效应(hydrophobic effect),即水溶液中非极性分子折叠或缔合的现象,说人话就是,油与水不互溶。
疏水效应说起来很简单直观,但它却是个狠角色!比如,在蛋白折叠、药物-蛋白相互作用,及蛋白-蛋白相互作用中,疏水效应常常是决定性因素之一呢[1]!
说到疏水性在药物-蛋白相互作用中的重要影响,事实上大部分上市的小分子药物都有一定的疏水性[2]。实验也表明,疏水相互作用对结合的贡献是十分巨大的,可以达到约30 cal / (mol· ?)。这是什么概念呢?比如,添加一个甲基(-CH3)产生的疏水相互作用,对结合自由能的贡献是0.7kcal/mol,或者说可以提升3.5倍左右的活性[1]!
疏水相互作用如此普遍又如此重要,你会不会很好奇,它的本质到底是什么?嗯,我们就是欣赏这种求索的精神!今天,小编就和大伙儿深扒一下疏水相互作用,并且还会聊到二号主角:去溶剂化(Desolvation)。
说到氢键或者离子键的本质,可以理解为电子云一定程度的分布交叠或者静电相互作用。但是,疏水相互作用却无法从原子间的力来理解,比如你很难解释苯环上的一个碳原子究竟是通过什么原子间作用力勾搭上甲基的碳原子,形成疏水相互作用的。
那么,驱动疏水相互作用的到底是何方神圣呢?
说出来,其实一点也不神秘,它就是“熵”(Entropic)[3]!我们知道在恒温恒压体系下可以用吉布斯自由能(Gibbs Free Energy)判断热力学过程是否自发,其方程如下:
ΔG=ΔH?TΔS
这个方程也来描述溶质的溶解过程,当ΔG<0代表溶解过程自发,反之则不是。方程式中ΔH指焓变,ΔS指的是熵变。
其实这个方程也可以用来描述药物分子和蛋白的相互作用过程:任何的药物结合过程其实都是焓变和熵变的共同结果,只是我们在理解结合过程时往往忽略了熵变的作用。
熵,是啥玩意儿呢?官方定义,熵是体系下所有微观状态数的总和的自然对数值乘以玻尔兹曼常数。对这个定义看不懂也没关系,我们只需要知道,从自由能的角度,如果某种变化使得体系有更多的状态数,则有利于这种变化的自发。
回到我们的疏水作用上,如果我们将疏水性的溶质丢进水中,那自由能如何变化呢?首先水中本来的氢键网络将会被破坏以腾出空间给疏水性溶质,这是一个吸热过程。紧接着,在疏水性溶质周围,水分子将会形成一个类似牢笼的结构,形成更加有序的氢键。
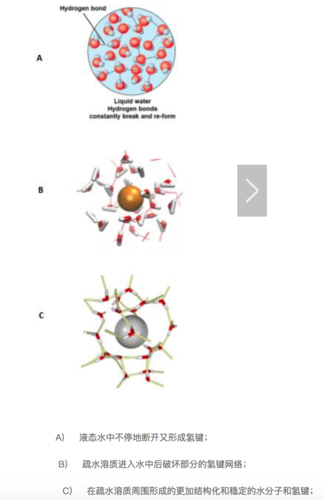
我们细想一下会发现,整个过程中的焓变(ΔH)很难说是正、负或者不变的,因为新形成的氢键或许能补偿第一步打断的氢键的能量。但是,疏水性溶质周围更加有序(结构化)的水分子将使得体系的熵变(ΔS)减小,并且这个变化往往比焓变的变化更大。根据吉布斯自由能公式,ΔG=ΔH?TΔS,较小的ΔH(正负未知)减去一个负的较大的ΔS,这个结果是正的,代表着疏水性溶质无法自发的溶解到水中。当疏水性溶质聚集时,这个聚集的整体与水的接触表面比溶质完全均匀分散在溶液中的接触表面小,有序化的水分子降到最少,自由的、有更多状态数的水分子达到最多,同时熵也最大,这就是疏水效应。
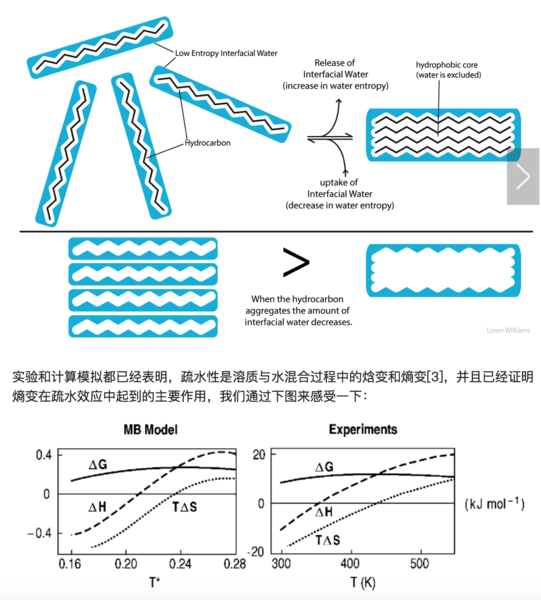
上图表示不同温度下溶质溶解的焓变、熵变和吉布斯自由能变化。横轴代表不同温度。左图是LJ溶质溶解到MB水溶液中的理论预测结果,右图是疏水溶质溶解的实验结果。横轴代表温度,可以看到不同温度下疏水性溶质的溶解吉布斯自由能都是正的,也就是说,不能自发溶解。
回到小分子药物与蛋白相互作用体系上,现在有人问你,为什么加入疏水性基因可以提高药物分子的活性呢?领悟了如上所述的攻略,你是不是很轻松地就能找到答案:因为疏水性基团进入疏水性的蛋白口袋,使得整体的疏水性基团尽量少的暴露在水溶液中,于是就使体系更加稳定从而提升活性。这个回答可以给满分吧?^_^
但是呢,还没完,如果我告诉你,疏水基团与亲水基团的替换,甚至可以让活性变化4万倍,你会不会觉得难以置信?
来,不急,我们继续聊~ 故事还是得从疏水效应说起:在某些体系中,疏水性蛋白表面用一些合适的疏水性原子占据,我们发现,这对结合自由能的贡献可以达到几个kcal/mol [4]!比如下面这个例子:

factor Xa和其抑制剂的结晶结构(PDB Code 2j4i)
上图是factor Xa和其抑制剂(From GSK)的结晶结构(PDB Code 2j4i),其Ki是1nM,但是如果将图示中高亮出的异丙基替换成氢(H),其活性直接下降到39μM,活性直接相差了4万倍!
上图例子中可以看到,Tyr99、Trp215和Phe174组成的疏水性的结合空腔,通过配体上的异丙基形成疏水相互作用,从而提高活性。但是这一次,不提则已,一提就是惊人的4万倍!这是为什么呢?
要说清楚这个问题,就得请出今天的二号主角,也是大家在药物设计中容易忽略的,去溶剂化效应(desolvation)。
如下图清晰的描述了该过程,药物分子在水溶液环境里进入靶标蛋白结合空腔的过程中,需要脱离原来的水环境,并且将靶标结合口袋中的水排出,这个过程中耗散或获得的能量就是去溶剂化能。
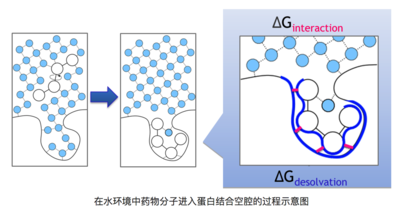
在水环境中药物分子进入蛋白结合空腔的过程示意图
回到factor Xa的例子,我们在3D结构中看一下结合口袋的位置(下图),很明显,结合口袋并未深入蛋白质内部,而是在靠近溶剂可及的表面。假设没有疏水性的异丙基占据,疏水性空腔位置可能占据着一些水分子,同样这些在疏水表面的水分子会更加的有序其状态数会较少,从而对结合自由能有不利的贡献;而通过异丙基能够帮助排出这些水分子,从而获得除了疏水相互作用外的一部分能量,所以活性被大大提升了[5,6]。从这个例子中我们可以看到,药物设计中我们还需要考虑在无配体结合状态下结合口袋可能的水化状态!
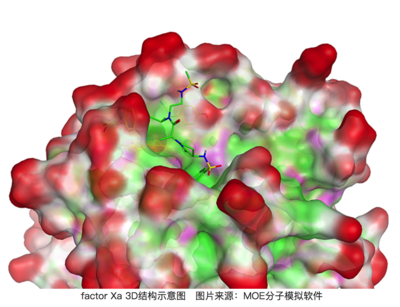
上图可以看到2j4i中的配体结合口袋在靠近蛋白表面,处于溶剂容易进入的区域。红色区域代表暴露溶剂中的区域,青色代表疏水区域,粉色代表极性基团区域。
值得注意的是,去溶剂化也有可能会导致看起来能够很好地与受体结合的分子其实并不能很好地结合。比如在一个针对HIV-1蛋白酶抑制剂耐药性的研究中发现,因为突变导致结合口袋的去溶剂化能显著提高,从而导致了耐药性[7]。
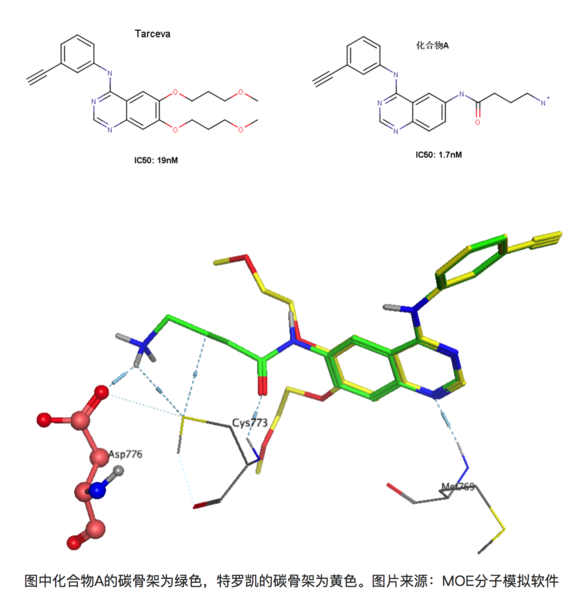
再比如在有喹唑啉母环的化合物是一类重要的EGFR(epidermal growth factor receptor,表皮生成因子受体)抑制剂,易瑞沙和特罗凯都属于该类药物。比如下图的两个化合物,左图为著名药物特罗凯,右图为发现的另外一个同系的EGFR抑制剂(暂且称为化合物A)[8]。右图化合物A能与EGFR 的Asp776形成离子键,大家知道离子键能达到的键能是极强的,理论上,与特罗凯相比,化合物A的活性提升应该远不止10倍。
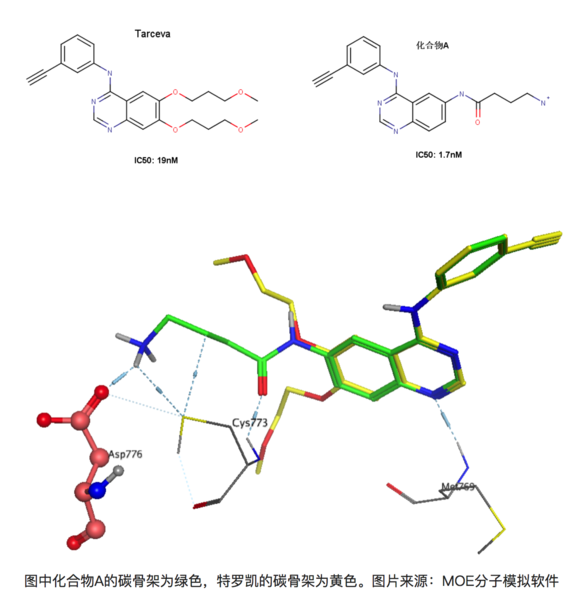
上图为化合物A和特罗凯的叠合结果,可以看到化合物A能和Asp776形成键能较强的离子键,但是活性却只提升了10倍!其实这正是由于去溶剂化能的影响,Asp776位于溶剂可及的蛋白表面上,容易与水形成较为稳定的氢键,因此要与-NH3+作用时必须脱离与某些水分子的作用而耗费一定的能量。同理,化合物A上的-NH3+也是一样的,需要断开一部分与水形成的氢键在于Asp776的羧基相互作用。因此看似形成很强的氢键,但是由于去溶剂化的作用,其活性的提升未必有想象中的理想。

随着电子产品防水需求的不断提高,从原先的 IP54到现在的IP67IP68等级!市场上出现了防水透气膜和防水透音膜,目前这两种不同的材料应用被搞混了,今天便与大家一起讨论防水透气
最近各地降雨量激增,所以手机就难免会沾点水,作为生活中不可或缺的电子产品,防水已经成为一个十分重要重要功能,而且个人对目前的IP68手机市场是相当不满意的。为什么?太贵
自然界中荷叶具有出淤泥而不染的典型不沾水特性(学术上称为Cassie-Baxter状态),具有自清洁、抗结冰、减阻、抗腐蚀等广泛应用价值,而玫瑰花瓣则具有水滴高粘附特性(称为Wenze

派瑞林各种粉材真空镀膜技术加工 纳米涂层防水处理
派瑞林各种粉材真空镀膜技术加工 纳米涂层防水处理

高阻隔强绝缘防汗液涂层蓝牙耳机3C电子产品IPX7纳米材料
高阻隔强绝缘防汗液涂层蓝牙耳机3C电子产品IPX7纳米材料

耐磨超疏水纳米材料 绝缘子架空导线电缆桥梁防覆冰涂层
耐磨超疏水纳米材料 绝缘子架空导线电缆桥梁防覆冰涂层

真空等离子气相沉积技术纳米防水镀膜加工 产能5万片天
真空等离子气相沉积技术纳米防水镀膜加工 产能5万片天
亲水疏油自洁净纳米涂层 易去污 无机防紫外高硬度材料
亲水疏油自洁净纳米涂层 易去污 无机防紫外高硬度材料

台湾超亲水防雾塑料专用 附着力好 透过率高 持久有效
台湾超亲水防雾塑料专用 附着力好 透过率高 持久有效


